
Prof. Dr. rer. nat. Thomas Wieder (Dipl. Biochemiker)
Kommissarischer Leiter der Forschungsgruppe
Nach dem Abitur am Gottlieb-Daimler Gymnasium in Stuttgart-Bad Cannstatt absolvierte Prof. Dr. Thomas Wieder von 1984 bis 1990 das Studium der Biochemie an der Freien Universität Berlin, das er im Juli 1990 mit dem Diplom in Biochemie abschloss. Seine Promotion zum Thema der Wirkungsweise antiproliferativer Phospholipidanaloga fertigte Prof. Dr. Wieder in der Gruppe von Prof. Dr. Werner Reutter am Institut für Molekularbiologie und Biochemie am Fachbereich Grundlagenmedizin der Freien Universität Berlin an, wo ihm im Mai 1993 vom Fachbereich Chemie der Freien Universität Berlin der Titel eines Doktors der Naturwissenschaften verliehen wurde. Nach seiner Postdoc-Zeit an der Haut- und Poliklinik des Universitätsklinikums Benjamin Franklin der Freien Universität Berlin (Prof. Dr. Constantin Orfanos und Prof. Dr. Christoph Geilen) und zwei von der Deutschen Forschungsgemeinschaft geförderten Auslands-aufenthalten am John Wayne Cancer Institute (Santa Monica, CA, USA) und an der Duke University (Durham, NC, USA) legte Prof. Dr. Wieder 1998 seine Habilitation inkl. Lehrbefugnis in Biochemie an der Freien Universität Berlin am Fachbereich Medizin ab. Seine Habilitationsschrift befasste sich mit der Synthese, der Struktur und der Wirkungsweise antiproliferativer Lipidanaloga. Im Juni 1998 wechselte Prof. Dr. Wieder als Laborleiter an die Medizinische Klinik mit Schwerpunkt Hämatologie, Onkologie und Tumorimmunologie an der Charité in Berlin. Hier beschäftigte er sich 4 Jahre lang mit klassischer Apoptoseforschung, bevor er 2002 als Oberassistent an das Physiologische Institut I der Medizinischen Fakultät der Eberhard-Karls-Universität Tübingen wechselte. Dort beforschte er zusammen mit Prof. Dr. Florian Lang und anderen Mitarbeiter/innen des Instituts intensiv einen Spezialfall des programmierten Zelltods: die Eryptose, das heißt den programmierten Zelltod der kernlosen Erythrozyten. Im September 2006 ging Prof. Dr. Wieder zurück in die dermatologische Forschung an die Universitäts-Hautklinik des Universitätsklinikums Tübingen unter Leitung von Prof. Dr. Martin Röcken, diesmal mit den Forschungsschwerpunkten Immuntherapie und Seneszenz. Im Juni 2010 wurde ihm von der Universität Tübingen der Titel außerplanmäßiger Professor verliehen. Seit November 2020 ist Prof. Dr. Wieder nun kommissarischer Leiter des Physiologischen Instituts, Abteilung für Vegetative und Klinische Physiologie.
Forschungsgruppe Physiologie und Pathophysiologie roter Blutkörperchen (Erythrozyten)
Multifunktionalität und anti-inflammatorische Aspekte
Eine Referenzperson, die 20-30 Jahre alt, 70 kg schwer und 170 cm groß ist, besitzt insgesamt ~30 Billionen Zellen. Dabei machen Erythrozyten (human red blood cells, hRBC) mit ~25 Billionen ca. 84% der Gesamtzellen aus. Die Abbildung 1 veranschaulicht die prozentuale Verteilung der Anzahl menschlicher Zellen nach Zelltyp [1].
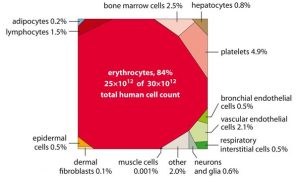
Abbildung 1: Prozentuale Verteilung menschlicher Zellen nach Zelltypen. Übernommen aus [1]. Adipocytes, Fettzellen; bone marrow cells, Knochenmarkzellen; bronchial endothelial cells, Lungenendothelzellen; dermal fibroblasts, Hautfibroblasten; epidermal cells, Epidermale Zellen; hepatocytes, Leberzellen; lymphocytes, Lymphozyten; muscle cells, Muskelzellen; neurons and glia, Neurone und Gliazellen; platelets, Blutplättchen; respiratory interstitial cells, interstitielle Zellen des Atemtrakts; vascular endothelial cells, Gefäßendothelzellen.
Hinzu kommen ~38 Billionen Bakterien, die bei einer Referenzperson über den ganzen Körper und v.a. im Darm verteilt sind. Diese Bakterien als essentieller Bestandteil unseres Mikrobioms machen ~0,3 % des gesamten Körpergewichts aus (für weitere Details siehe [1]). Zirkulierende hRBCs haben eine Lebensdauer von 120 Tagen [2]. Täglich werden also ca. 1% (~250 Milliarden) der zirkulierenden hRBCs abgebaut und gleichzeitig im Knochenmark durch Erythropoese (Neubildung der Erythrozyten) ersetzt, das entspricht folglich zwei Millionen hRBCs pro Sekunde.
Verkürzt kann man die induzierte Bildung von hRBCs durch Erythropoese wie folgt zusammenfassen:
Hypoxie → Leber & v. a. Niere → Hif-2a/Hif-b-Hochregulation → EPO Produktion → Knochenmark → verstärkte Erythropoese.
Eine Dysregulation der Erythropoese führt zur Polyzythämie bzw. Anämie. Anämien können grob in Eisenmangelanämien (iron-deficiency anemia/IDA) und Entzündungs-bedingte Anämie (anemia of inflammation bzw. anemia of chronic disease/ACD)) unterteilt werden. IDA kann normalerweise durch Zufuhr von Eisen-haltiger Nahrung behoben werden. Bei ACD hingegen ist das körpereigene gespeicherte Eisen reichlich vorhanden, jedoch nicht für die Erythropoese verfügbar. Das Spektrum von ACD umfasst viele Krankheiten wie: rheumatoide Arthritis, Lupus Erythematodes, Parodontal-Erkrankungen, diverse low-grade Infektionen, Malaria, Krebs, Nierenversagen und Herzerkrankungen. Die Hauptursache für die gestörte Eisenfreisetzung ist das von Hepatozyten freigesetzte Protein Hepcidin, das an Ferroportin bindet und zu dessen Internalisierung und Proteolyse führt, wodurch die Fähigkeit der Speicherzellen, Eisen zu exportieren, effektiv verringert wird. Die Behandlung von ACD umfasst die gleichzeitige Verabreichung von EPO und intravenöses Eisen.
Erythrozyten sind kern- und organellenfreie Zellen, die im Prinzip nur aus einer Zellmembran und dem darin befindlichen Zytoskelett inkl. der zytosolischen Proteine und niedermolekularen Substanzen bestehen. Die Hauptbestandteile aller biologischen Membranen sind Proteine, Lipide und Kohlenhydrate in unterschiedlichen Anteilen. Letztere machen <10% der Masse der meisten Membranen aus und sind in der Regel entweder an die Lipid- oder die Proteinkomponenten gebunden. Die wichtigsten Membranlipide sind Phospholipide, Cholesterin und Glykolipide. Glykolipide fungieren als Zellantigene und bestimmen zusammen mit Glykoproteinen die Oberflächenmerkmale einer Zelle, die sie von anderen Zellen unterscheiden. Die menschliche Erythrozytenmembran wiederum besteht aus 40% Lipiden (Phospholipide, Sphingolipide, Triglyzeride und Cholesterol), 52% Proteinen und 8% Kohlenhydraten. In wässriger Umgebung assoziieren Phospholipide spontan zu einer Doppelschicht, wobei ihre polaren, hydrophilen Kopfgruppen dem wässrigen Medium zugewandt sind. Solche Doppelschichten sind die strukturelle Grundlage aller Zellmembranen. Die Funktionalität einer Zelle ist direkt mit der asymmetrischen Verteilung der Phospholipide innerhalb der doppelschichtigen Zellmembran assoziiert, wobei die Cholin-haltigen Phospholipide (Phosphatidylcholin (PC) und Sphingomyelin (SM)) vorwiegend auf der äußeren Schicht und Phosphatidylethanolamin (PE), Phosphatidylserin (PS) sowie Phosphtatidylinositol (PI) zum größten Teil in der inneren Schicht der Membran lokalisiert sind. Unter physiologischen Bedingungen und bei einer Temperatur von 37 °C befinden sich die Phospholipide in einem flüssig-kristallinen Zustand (liquid-crystal state), in dem die Membranproteine sich nach den Seiten hin bewegen können. Die vier Hauptphospholipide (PC, PE, PS und SM) sind in Abbildung 2 dargestellt.
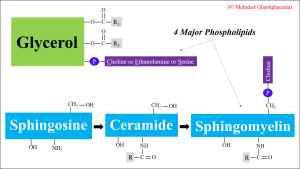
Abbildung 2: Phospholipide der Zellmembran. R1, R2, R stellen Fettsäurereste dar. © Mehrdad Ghashghaeinia.
Cholesterin ist ein weiteres wichtiges Lipid, das in großer Konzentration in der Plasmamembran von Säugetierzellen sowie hRBCs vorkommt. Unter physiologischen Bedingungen liegt das molare Verhältnis von Cholesterin zu Phospholipid bei 0,82 [3]. Die Rolle des Cholesterins ist aufgrund mangelnden Wissens nach wie vor höchst umstritten. Zum einen ist eine ausbalancierte Menge an Cholesterin notwendig für das Wachstum und Überleben der Zellen. Überschüssige Mengen dieses wasserunlöslichen Stoffes lagern sich allerdings in oder an arteriellen Gefäßen und Gefäßzellen ab und verstärken dadurch die Entwicklung von Atherosklerose. Daher stehen die Säugetierzellen vor dem Dilemma entweder a) ausreichend Cholesterin für das Wachstum und die Erneuerung der Membran bereitzustellen oder b) eine andauernde übermäßige Synthese und Akkumulation dieses Lipids zu vermeiden. Zusammenfassend kann man sagen, dass ein direkter Zusammenhang zwischen Cholesteringehalt, struktureller Integrität und Überlebensgrad in hRBCs besteht. Cholesterindepletion führt Spezies-übergreifend zur einer erhöhten Externalisierung von PS (loss of membrane PS asymmetry) und somit zur Phagozytose und Eliminierung der Erythrozyten [4,5]. Die Abbildung 3 illustriert sowohl die PS-Externalisierung als Zeichen des Erythrozytentods (im folgenden als Eryptose bezeichnet) als auch die damit assoziierten Veränderungen der intrazellulären Ionenzusammensetzung.
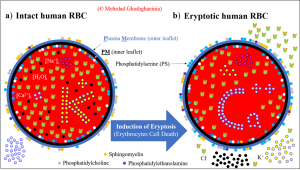
Abbildung 3: Veränderung der Phosphatidylserin (PS)-asymmetrie und Ionenzusammensetzung während der Induktion des programmierten Erythrozytentods (Eryptose). Die blauen Kreise an der Membran stellen PS dar. In intakten Erythrozyten (a) befinden sich die meisten PS-Moleküle auf dem inneren Blatt der Lipiddoppelschicht und Ca2+ ist hauptsächlich extrazellulär. In eryptotischen Zellen (b) wechselt PS auf die Außenseite der Membran, und Ca2+ flutet das Zytosol der hRBCs. © Mehrdad Ghashghaeinia.
Das Phänomen der Eryptose wird i.d.R. begleitet von einem Ca2+-Einstrom in die Erythrozyten bei einem gleichzeitigen Austritt von Wasser-, Kalium (K+)- und Chlorid (Cl-)-Ionen aus den Zellen. Man spricht in diesem Zusammenhang auch von einer Eryptose-induziertern Erythrozytenschrumpfung. Allerdings zeigt sich unter bestimmten Umständen, wie z. B. im Fall der vom Medikament Trifluoperazin (TFP) induzierten Eryptose, konzentrationsabhängig sowohl eine Schrumpfung als auch ein Anschwellen der hRBCs bei PS-positiven, also eryptotischen Zellen (siehe Abbildung 4 und [6]).

Abbildung 4: Anschwellen oder Schrumpfung während der Induktion des programmierten Erythrozytentods (Eryptose). A) Trifluoperazin-induzierte Externalisierung von PS. B) Trifluoperazin-induzierte Veränderung des Forward Scatters als Maß für die Größe der Erythrozyten. Es ist zu beachten, dass PS-positive Zellen bei 5 µM TFP größer als die Kontrollzellen (DMSO) sind, während PS-positive Zellen bei 10 µM TFP kleiner als die Kontrollzellen sind (siehe auch [6]).
In intakten hRBCs trägt der hohe Cholesteringehalt zur Stabilität und Funktionstüchtigkeit der Zellmembran bei; dadurch wird sowohl die hypotone als auch die Druck-induzierte Hämolyse weitestgehend unterbunden [7] (Abbildung 5). Auch wird eine inhibitorische Wirkung auf hydrolytische Enzyme wie z.B. die sekretorische Phospholipase A2 (sPLA2) ausgeübt [8]. Ein wichtiger früher Schritt bei der Atherosklerose ist die Bindung von Apolipoprotein B-100 (apoB-100)-haltigen Lipoproteinen (VLDL, IDL und LDL) an die Proteoglykan-Komponente der extrazellulären Matrix der arteriellen Intima. Die nicht-oxidativen Modifikationen von Proteoglykan-gebundenen-apoB-100-haltigen Lipoproteinen (LPs) durch sPLA2, das heißt die Hydrolyse der Phosphatidylcholin (PC) Moleküle in diesen LPs ist ein Schlüsselfaktor bei der Entstehung der Atherosklerose.
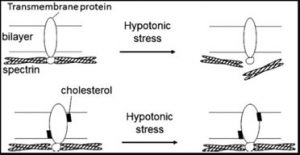
Abbildung 5: Stabilisierung der Erythrozytenmembran durch Cholesterol. Übernommen aus [7].
Der essentielle Bedarf an Cholesterin in Säugetierzellen lässt sich zum Teil auf seine wichtige Rolle in den Membranen zurückführen. Cholesterin geht hierbei Interaktionen mit Membranproteinen ein, die durch seine Bindung an spezifischen Stellen dieser Membranproteine entstehen. Eine Reihe von Ionenpumpen der Plasmamembran werden dadurch positiv von Cholesterin reguliert, darunter die 3Na+-2K+-ATPase, die für transmembranäre Ionengradienten verantwortlich ist. Von der Aktivität dieser Ionenpumpen hängen etliche zelluläre Funktionen ab [9,10]. Auf der anderen Seite verlieren viele Membranenzyme jedoch bei sehr hohem Membrancholesteringehalt ihre Aktivität. Dies ist aber auf eine separate Eigenschaft von Cholesterin zurückzuführen; sehr hoher Cholesteringehalt verstärkt die Bewegungsordnung der Membranlipide, wodurch die Transmembranpermeabilität reduziert und die Konformationsflexibilität des Transmembranproteins gehemmt werden [11]. Unter physiologischen Bedingungen enthält ein einziger Eythrozyt ~190 Millionen (1,9 x 108) Phospholipide [12] und ~160 Millionen (1,6 x 108) Cholesterin-Moleküle [3]. Angesichts dieser Tatsachen sollte die Diskussion über erhöhte „freie“ Cholesterinwerte nicht zu einseitig geführt werden.
hRBCs spielen auch eine wichtige Rolle bei Immun- und Abwehrmechanismen. So vermitteln zum Beispiel Komplement 3b und Komplementrezeptor 1 die Anheftung von Erythrozyten an sich im Blutplasma befindenden Bakterien. Dies führt zur Phagozytose von Erythrozyten-gebundenen Bakterien in der Leber und der Milz, wobei die Rückführung der nach wie vor intakten Erythrozyten in den Blutkreislauf in diesem Mechanismus eingeschlossen ist. hRBCs fungieren weiterhin als Behältnis für Sphingosin-1-Phosphat (S1P). Sie geben dieses Molekül bei Bedarf über einen fein regulierten Mechanismus an das Blutplasma ab. S1P reguliert die Lymphozyten-zirkulation, erhält die Integrität der Endothelzellbarriere aufrecht und übt eine schützende Wirkung auf die Niere aus. Darüber hinaus wird die vaskuläre Entwicklung der Niere durch das Zusammenspiel von S1P, hRBCs und vaskulärem Endothel positiv reguliert. hRBCs sind mittels eines spezifischen Chemokinrezeptors zudem in der Lage, eine Reihe der entzündlichen Chemokine, einschließlich IL-8, zu binden und so überschießende Entzündungsreaktionen einzudämmen. Interessanterweise entwickeln 20% der mit SARS-CoV-2 infizierten Patienten ein akutes Atemnotsyndrom, das mit einer erheblichen Freisetzung von Chemokinen und pro-inflammatorischen Zytokinen (zum Beispiel IL-8) einhergeht und schlußendlich in einem Multiorganversagen gipfelt. Diese Daten zeigen, dass hRBCs nicht nur respiratorische, sondern auch anti-inflammatorische und immunmodulierende Funktionen inne haben können. Daher ist die Anwendung von Substanzen, welche die Vitalität der Erythrozyten verbessern und gleichzeitig Pathogene beziehungsweise Pathogen-infizierte Wirtszellen eliminieren, eine gute Wahl und möglicherweise von großer Bedeutung für die Behandlung infektiöser Erkrankungen wie COVID-19 (für weitere Details siehe [13] sowie Abbildung 6).
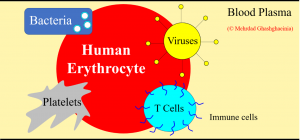
Abbildung 6: Interaktionen zwischen humanen Erythrozyten und körpereigenen Zellen (Blutplättchen und T Zellen) sowie Pathogenen (Bakterien und Viren). © Mehrdad Ghashghaeinia.
Referenzen
1. Sender, R.; Fuchs, S.; Milo, R. Revised Estimates for the Number of Human and Bacteria Cells in the Body. PLoS Biol 2016, 14, e1002533, doi:10.1371/journal.pbio.1002533.
2. S.T. Callender, E.O.P., L.J. Witts. The life-span of the red cell in men. Journal of Pathology and Bacteriology 1945, 57, 129-139.
3. Nikolic, M.; Stanic, D.; Antonijevic, N.; Niketic, V. Cholesterol bound to hemoglobin in normal human erythrocytes: a new form of cholesterol in circulation? Clin Biochem 2004, 37, 22-26, doi:10.1016/j.clinbiochem.2003.10.002.
4. van Zwieten, R.; Bochem, A.E.; Hilarius, P.M.; van Bruggen, R.; Bergkamp, F.; Hovingh, G.K.; Verhoeven, A.J. The cholesterol content of the erythrocyte membrane is an important determinant of phosphatidylserine exposure. Biochim Biophys Acta 2012, 1821, 1493-1500, doi:10.1016/j.bbalip.2012.08.008.
5. Lopez-Revuelta, A.; Sanchez-Gallego, J.I.; Garcia-Montero, A.C.; Hernandez-Hernandez, A.; Sanchez-Yague, J.; Llanillo, M. Membrane cholesterol in the regulation of aminophospholipid asymmetry and phagocytosis in oxidized erythrocytes. Free Radic Biol Med 2007, 42, 1106-1118, doi:10.1016/j.freeradbiomed.2007.01.010.
6. Ghashghaeinia, M.; Wesseling, M.C.; Ramos, E.; Petkova-Kirova, P.; Waibel, S.; Lang, E.; Bissinger, R.; Alzoubi, K.; Edelmann, B.; Hosseinzadeh, Z.; et al. Trifluoperazine-Induced Suicidal Erythrocyte Death and S-Nitrosylation Inhibition, Reversed by the Nitric Oxide Donor Sodium Nitroprusside. Cell Physiol Biochem 2017, 42, 1985-1998, doi:10.1159/000479838.
7. Yamaguchi, T.; Ishimatu, T. Effects of Cholesterol on Membrane Stability of Human Erythrocytes. Biol Pharm Bull 2020, 43, 1604-1608, doi:10.1248/bpb.b20-00435.
8. Heiner, A.L.; Gibbons, E.; Fairbourn, J.L.; Gonzalez, L.J.; McLemore, C.O.; Brueseke, T.J.; Judd, A.M.; Bell, J.D. Effects of cholesterol on physical properties of human erythrocyte membranes: impact on susceptibility to hydrolysis by secretory phospholipase A2. Biophys J 2008, 94, 3084-3093, doi:10.1529/biophysj.107.118356.
9. Shanmugasundaram, K.R.; Padmavathi, C.; Acharya, S.; Vidhyalakshmi, N.; Vijayan, V.K. Exercise-induced cholesterol depletion and Na+,K(+)-ATPase activities in human red cell membrane. Exp Physiol 1992, 77, 933-936, doi:10.1113/expphysiol.1992.sp003663.
10. Garcia, A.; Lev, B.; Hossain, K.R.; Gorman, A.; Diaz, D.; Pham, T.H.N.; Cornelius, F.; Allen, T.W.; Clarke, R.J. Cholesterol depletion inhibits Na(+),K(+)-ATPase activity in a near-native membrane environment. J Biol Chem 2019, 294, 5956-5969, doi:10.1074/jbc.RA118.006223.
11. Yeagle, P.L. Non-covalent binding of membrane lipids to membrane proteins. Biochim Biophys Acta 2014, 1838, 1548-1559, doi:10.1016/j.bbamem.2013.11.009.
12. Ferrell, J.E., Jr.; Huestis, W.H. Phosphoinositide metabolism and the morphology of human erythrocytes. J Cell Biol 1984, 98, 1992-1998, doi:10.1083/jcb.98.6.1992.
13. Ghashghaeinia, M.; Dreischer, P.; Wieder, T.; Koberle, M. Coronavirus disease 2019 (COVID-19), human erythrocytes and the PKC-alpha/-beta inhibitor chelerythrine -possible therapeutic implication. Cell Cycle 2020, 19, 3399-3405, doi:10.1080/15384101.2020.1859197.
Autor: Dr. Mehrdad Ghashghaeinia
Forschungsgruppe Signalwege und Relevanz der Zytokin-induzierten Seneszenz
Das Konzept der Seneszenz beschreibt die mit Beginn des Lebens eintretende Alterung multizellulärer Organismen. Wie für die Entstehung von Tumoren beschrieben (Hanahan und Weinberg, 2011) wurden analog auch für die Alterung von Organismen bestimmte biologische Kennzeichen („Hallmarks“) gefunden. Dabei gilt die zelluläre Seneszenz als eine der wichtigsten „Hallmarks“ (Lopez-Otin et al., 2013). Neben seiner Bedeutung für die Gewebsalterung und -fitness (Baker et al., 2011) und für die Embryogenese (Munoz-Espin et al., 2013) spielt die zelluläre Seneszenz auch bei der Tumorentstehung eine große Rolle (Michaloglou et al., 2005). Die seneszente Zelle zeigt einen dreigeteilten Phänotyp: sie weist (i) einen permanenten Wachstumsarrest, (ii) eine Apoptoseresistenz und (iii) einen Seneszenz-assoziierten sekretorischen Phänotyp (SASP) auf. Ein Beispiel für eine postmitotische aber trotzdem alternde Zelle stellt der kernlose Erythrozyt dar. Interessanterweise sind alternde Eythrozyten anfälliger für den Stress-induzierten, programmierten Erythrozytentod (Eryptose) (Ghashghaeinia et al., 2012). Es liegt somit auf der Hand, dass es zwischen verschiedenen Formen der Seneszenz und verschiedenen Formen des Zelltods, wie z. B. der Eryptose, Überschneidungen gibt.
Die genaue Kenntnis der molekularen Vorgänge während der Seneszenz ist wegen der notwendigen Aussortierung der gealterten und teilweise auch geschädigten, seneszenten Zellen besonders wichtig. Hier ist zu beachten, dass insbesondere der SASP durch die Sekretion löslicher Wachstumsfaktoren und Chemokine sogar einen protumoralen Einfluss haben kann und damit als potentiell gefährlich einzuschätzen ist (Campisi, 2013).
Mit der Zytokin-induzierten Seneszenz (ZIS; Braumüller et al., 2013) wurde das oben beschriebene Konzept um eine wichtige Komponente erweitert, nämlich um die extrinsische, Rezeptor-vermittelte Induktion der zellulären Seneszenz (Wieder et. al., 2017).
Die ZIS ist in der Zwischenzeit als biologischer Mechanismus bestätigt worden, wobei als wichtige proseneszente Zytokine Transforming Growth Factor-β (TGF-β), Interferon-γ (IFN-γ) und Tumornekrosefaktor (TNF) nachgewiesen wurden (Reimann et al., 2010; Hubackova et al., 2016). Außerdem ist es gelungen, humane Tumorzellen durch eine Interleukin-12 (IL-12)-abhängige Immunreaktion auch in vivo in die Seneszenz zu treiben und dadurch das Tumorwachstum zu kontrollieren (Schilbach et al., 2015). Das ursprünglich nur in RIP-Tag2 Mäusen beschriebene Immunzellen-getriggerte Therapieprinzip (Müller-Hermelink et al., 2008; Braumüller et al., 2013) konnte somit auf humane Tumorzellen übertragen werden.
Die Immuntherapie von Tumoren hat seit dem Nachweis der klinischen Wirksamkeit der Immun-Checkpoint-Inhibitoren bei der Behandlung des metastasierenden Melanoms (Robert et al., 2011) einen großen Aufschwung erfahren (Wieder et al., 2016). Bei dieser neuartigen Therapieform scheinen auch nichttoxische Prinzipien wie die ZIS zu wirken (Wieder et al., 2016, 2017, 2018). Darauf deuten auch klinische Befunde hin, die zeigen, dass Patienten mit einem Rückfall der Erkrankung nach einer Immuntherapie häufig Mutationen im Interferon-Signalweg haben (Zaretsky et al., 2016).
Als wichtige molekulare Schalter bei der Onkogen- und der Doxorubicin-induzierten Seneszenz wurde das Argonautenprotein Ago2 beschrieben (Benhamed et al., 2012). In der Arbeitsgruppe konnten wir die Rolle dieses transkriptionsregulierenden Proteins in der ZIS bestätigen. Auch bei der ZIS kommt es zu einer Translokation von Ago2 in den Nukleus von Tumorzellen, wobei die Ago2-Translokation vor allem in den ersten 48 h nach Induktion ein Plateau erreicht. Weitere Arbeiten mit Ago2-siRNA zeigten zudem, dass insbesondere etliche Zellzyklusgene im Verlauf der ZIS durch Ago2 reguliert werden (Rentschler et al., 2018). Hier sind in Zukunft noch weitere Analysen notwendig, um den funktionellen Einfluss von Ago2 und anderen Transkriptionsfaktoren wie z. B. JunB auf den Zellzyklus und die Proliferation nachzuweisen. Auch die Rolle definierter posttranslationaler Modifikationen (wie z.B. Rezeptor-vermittelter Phosphorylierungen) wird zu analysieren sein.
Referenzen:
Baker, D.J., Wijshake, T., Tchkonia, T., LeBrasseur, N.K., Childs, B.G., van de Sluis, B., Kirkland, J.L. and van Deursen, J.M. (2011) Clearance of p16Ink4a-positive senescent cells delays ageing-associated disorders. Nature 479: 232-236.
Benhamed, M., Herbig, U., Ye, T., Dejean, A. and Bischof, O. (2012) Senescence is an endogenous trigger for microRNA-directed transcriptional gene silencing in human cells. Nat. Cell Biol. 14: 266-275.
Braumüller, H., Wieder, T., Brenner, E., Aßmann, S., Hahn, M., Alkhaled, M., Schilbach, K., Essmann, F., Kneilling, M., Griessinger, C., Ranta, F., Ullrich, S., Mocikat, R., Braungart, K., Mehra, T., Fehrenbacher, B., Berdel, J., Niessner, H., Meier, F., van den Broek, M., Häring, H.-U., Handgretinger, R., Quintanilla-Martinez, L., Fend, F., Pesic, M., Bauer, J., Zender, L., Schaller, M., Schulze-Osthoff, K., and Röcken, M. (2013) T-helper-1-cell cytokines drive cancer into senescence. Nature 494: 361-365.
Campisi, J. (2013) Aging, cellular senescence, and cancer. Annual Review of Physiology 75: 685-705.
Ghashghaeinia, M., Cluitmans, J.C.A., Akel, A., Dreischer, P., Toulany, M., Köberle, M., Skabytska, Y., Saki, M., Biedermann, T., Duszenko, M., Lang, F., Wieder, T., and Bosman, G.J.C.G.M. (2012) The impact of erythrocyte age on eryptosis. Br. J. Haematol. 157: 606-614.
Hanahan, D. and Weinberg, R.A. (2011) Hallmarks of cancer: the next generation. Cell 144: 646-674.
Hubackova, S., Kucerova, A., Michlits, G., Kyjacova, L., Reinis, M., Korolov, O., Bartek, J. and Hodny, Z. (2016) IFN- induces oxidative stress, DNA damage and tumor cell senescence via TGFβ/SMAD signaling-dependent induction of Nox4 and suppression of ANT2. Oncogene 35: 1236-1249.
Lopez-Otin, C., Blasco, M. A., Partridge, L., Serrano, M. and Kroemer, G. (2013) The hallmarks of aging. Cell 153: 1194-1217.
Michaloglou, C., Vredeveld, L.C., Soengas, M.S., Denoyelle, C., Kuilman, T., van der Horst, C.M., Majoor, D.M., Shay, J.W., Mooi, W.J. and Peeper, D.S. (2005) BRAFE600-associated senescence-like cell cycle arrest of human naevi. Nature 436: 720-724.
Müller-Hermelink, N., Braumüller, H., Pichler, B., Wieder, T., Mailhammer, R., Schaak, K., Ghoreschi, K., Yazdi, A., Haubner, R., Sander, C. A., Mocikat, R., Schwaiger, M., Förster, I., Huss, R., Weber, W. A., Kneilling, M. and Röcken, M. (2008) TNFR1- and IFN--signaling determine whether T cells induce tumor dormancy or promote multistage carcinogenesis. Cancer Cell 13: 507-518.
Munoz-Espin, D., Canamero, M., Maraver, A., Gomez-Lopez, G., Contreras, J., Murillo-Cuesta, S., Rodríguez-Baeza, A., Varela-Nieto, I., Ruberte, J., Collado, M. and Serrano, M. (2013) Programmed cell senescence during mammalian embryonic development. Cell 155: 1104-1118.
Reimann, M., Lee, S., Loddenkemper, C., Dörr, J.R., Tabor, V., Aichele, P., Stein, H., Dörken, B., Jenuwein, T. and Schmitt, C.A. (2010) Tumor stroma-derived TGF-beta limits myc-driven lymphomagenesis via Suv39h1-dependent senescence. Cancer Cell 17: 262-272.
Rentschler, M., Chen, Y., Pahl, J., Soria-Martinez, L., Braumüller, H., Brenner, E., Bischof, O., Röcken, M. and Wieder, T. (2018) Nuclear translocation of Argonaute 2 in cytokine-induced senescence. Cell. Physiol. Biochem. 51: 1103-1118.
Robert, C., Thomas, L., Bondarenko, I., O'Day, S., Weber, J., Garbe, C., Lebbe, C., Baurain, J.F., Testori, A., Grob, J.J., Davidson, N., Richards, J., Maio, M., Hauschild, A., Miller, W.H., Gascon, P., Lotem, M., Harmankaya, K., Ibrahim, R., Francis, S., Chen, T.T., Humphrey, R., Hoos, A. and Wolchok, J.D. (2011) Ipilimumab plus dacarbazine for previously untreated metastatic melanoma. N Engl J Med. 364: 2517-2526.
Schilbach, K., Alkhaled, M., Welker, C., Eckert, F., Blank, G., Ziegler, H., Sterk, M., Müller, F., Sonntag, K., Wieder, T., Braumüller, H., Schmitt, J., Eyrich, M., Schleicher, S., Erbacher, A., Pichler, B.J., Müller, H., Tighe, R., Lim, A., Gillies, S.D., Strittmatter, W., Röcken, M. and Handgretinger, R. (2015) Cancer-targeted IL-12 controls human rhabdomyosarcoma by senescence induction and myogenic differentiation. OncoImmunology 4(7): e1014760.
Wieder, T., Brenner, E., Braumüller, H. and Röcken, M. (2016) Immunotherapy of melanoma: efficacy and mode of action. J. Dtsch. Dermatol. Ges. 14: 28-36.
Wieder, T., Brenner, E., Braumüller, H., Bischof, O. and Röcken, M. (2017) Cytokine-induced senescence for cancer surveillance. Cancer Metastasis Rev. 36: 357-365.
Wieder, T., Eigentler, T., Brenner, E. and Röcken, M. (2018) Immune checkpoint blockade therapy. J Allergy Clin. Immunol. 142: 1403-1414.
Zaretsky, J.M., Garcia-Diaz, A., Shin, D.S., Escuin-Ordinas, H., Hugo, W., Hu-Lieskovan, S., Torrejon, D.Y., Abril-Rodriguez, G., Sandoval, S., Barthly, L., Saco, J., Homet Moreno, B., Mezzadra, R., Chmielowski, B., Ruchalski, K., Shintaku, I.P., Sanchez, P.J., Puig-Saus, C., Cherry, G., Seja, E., Kong, X., Pang, J., Berent-Maoz, B., Comin-Anduix, B., Graeber, T.G., Tumeh, P.C., Schumacher, T.N., Lo, R.S. and Ribas, A. (2016) Mutations Associated with Acquired Resistance to PD-1 Blockade in Melanoma. N. Engl. J. Med. 375: 819-829.
| 2011 | Posterpreis Kolloquium, Medizinische Fakultät der Eberhard-Karls-Universität Tübingen Die Rolle p16Ink4a-gesteuerter Signalwege in der Zytokin-induzierten Wachstumskontrolle. Autoren: M. Hahn, Th. Wieder, H. Braumüller, S. Weidemann, E. Brenner, K. Schilbach-Stückle, M. Röcken. Bestes Poster im Promotionskolleg. |
| 2013 | Paper of the Year 2013, Forschungskolloquium der Medizinischen Fakultät der Eberhard-Karls-Universität Tübingen T-helper-1-cell cytokines drive cancer into senescence. Nature 494: 361-365. Autoren: H. Braumüller, Th. Wieder, E. Brenner, S. Aßmann, M. Hahn, M. Alkhaled, K. Schilbach, F. Essmann, M. Kneilling, C. Griessinger, F. Ranta, S. Ullrich, R. Mocikat, K. Braungart, T. Mehra, B. Fehrenbacher, J. Berdel, H. Niessner, F. Meier, M. van den Broek, H.-U. Häring, R. Handgretinger, L. Quintanilla-Martinez, F. Fend, M. Pesic, J. Bauer, L. Zender, M. Schaller, K. Schulze-Osthoff, M.Röcken. Paper of the Year 2013 in der Kategorie Grundlagenforschung. |
| 2014 | Tuevalon Lehrpreis der Medizinischen Fakultät der Eberhard-Karls-Universität Tübingen Physiologie und Pathophysiologie von Organsystemen I Modulverantwortlicher: S. Huber; Vorlesung Blut I und II: Th. Wieder. Bestes Modul im Grundstudium B.Sc. Medizintechnik. |
| 2016 | Lehrpreis Medizintechnik der Medizinischen Fakultät der Eberhard-Karls-Universität Tübingen und der Universität Stuttgart Physiologie und Pathophysiologie von Organsystemen II Modulverantwortliche: M. Knipper; Vorlesungen Endokrinologie: Th. Wieder. Beste Veranstaltung 1. Platz im Grundstudium B.Sc. Medizintechnik. |
- Reutter, W. (Anmelder), Mulzer, J. (Vertreter), Buchner, K., Geilen, C. C., Mickeleit, M., Wieder, Th. (1998) Verfahren zur Herstellung glykosidierter Phospholipide, besonders glucosidiertes Lecithin, und dessen proliferationshemmende Wirkung epithelialer Zellen, besonders der Keratinocyten, Offenlegungsschrift DE 195 47 827 A 1, Bundesdruckerei 05.98 802 027/1/1.
- Schmalz, H. G. (Anmelder), Universitätsklinikum Charité (Anmelder), Prokop, A., Wieder, Th., Daniel, P. (2002) Substanzen zur Therapie von Erkrankungen, die durch hochproliferierende Zellen verursacht werden, PCT Internationale Patentanmeldung WO 02/080923 A1, [Chem. Abstr. 2002, 137, 295194; AN 2002:793423]; Patentnr. (EPA): 02742877.0-2123-EP0203835.
- Universitätsklinikum Charité (Anmelder), TU München (Anmelder), Riepl, H., Wieder, Th., Prokop, A. (2003) 8-Nitro-Tryptanthrin und andere Tryptanthrin-Derivate zur Therapie von Erkrankungen, die durch hoch-proliferierende Zellen verursacht werden, Deutsche Patentanmeldung 10315654.2, Anmeldungsnummer (EPA): PCT/EP2004/ 003467.
- Universitätsklinikum Charité (Anmelder), Schmalz, H. G., Prokop, A., Wieder, Th. (2004) Nukleosidanaloga mit Apoptose-induzierenden Eigenschaften zur Therapie durch hoch-proliferierende Zellen verursachter Erkrankungen, Patentnummer (EPA): 04709602.9-2117-EP2004001212.
- Universitätsklinikum Tübingen (Anmelder), Ghashghaeinia, M., Ghoreschi, K., Lang, F., Röcken, M., Wieder, Th. (2008) Arzneimittel zur Behandlung einer durch Parasiten verursachten Krankheit, Deutsche Patentanmeldung 10 2008 030 023.3-41.
- Universitätsklinikum Tübingen (Anmelder), Ghashghaeinia, M., Ghoreschi, K., Lang, F., Röcken, M., Wieder, Th. (2008) Arzneimittel zur Behandlung einer durch Parasiten verursachten Krankheit, Internationale Patentanmeldung PCT/EP2009/004359.
- Universitätsklinikum Tübingen (Anmelder), Ghashghaeinia, M., Ghoreschi, K., Lang, F., Röcken, M., Wieder, Th. (2009) Use of dimethyl fumarate or its derivative for the preparation of a medicament to prevent and/or treat diseases caused by parasite, preferably in living organisms, where the disease is malaria, trypanosomiasis and filariasis, Deutsche Patentnummer DE10 2008 030 023-A1.
- Röcken, M. (Anmelder), Braumüller, H., Brenner, E., Assmann, S., Hahn, M., Braungart, K., Wieder, Th. (2012) Tumorprävention und –therapie durch Induktion einer Tumorseneszenz, Deutsche Patentnummer: DE102012024749A1.
- Röcken, M. (Anmelder), Braumüller, H., Brenner, E., Assmann, S., Hahn, M., Braungart, K., Wieder, Th. (2013) Verwendung von Wirkstoffkombinationen zur Induktion einer Tumorseneszenz, Europäische Patentanmeldung 13826993.1 – 1403.
- Röcken, M. (Anmelder), Braumüller, H., Brenner, E., Assmann, S., Hahn, M., Braungart, K., Wieder, Th. (2014) Use of active substance combinations for inducing tumour senescence, Internationale Patentanmeldung PCT/DE2013/000794, Internationale Patentnummer: WO201409 0224 A1.
- Röcken, M. (Anmelder), Wieder, Th., Hahn, M., Brenner, E., Braumüller, H., Braungart, K., Assmann, S. (2018) Method of inducing senescence in tumor cells by administrating TNF-a in combination with IFN-a or IFN-g, United States Patent, Patent No.: US 10,046,029 B2.
- Ghashghaeinia M (2020, Anmelder), Active ingredient of an erythrocytes-containing composition, Europäische Patentanmeldung 20 155 897.0.
-
Ghashghaeinia M (2019, Anmelder), Pharmaceutical composition containing Bay 11-7082, parthenolide or a combination thereof for the treatment of obesity or cardiovascular diseases.US Patent 10,420,746, B2.
- Rentschler, M., Braumüller, H., Briquez, P.S., and Wieder, Th. (2022)
„Cytokine-induced senescence in the tumor microenvironment and its effects on anti-tumor immune responses.“
Cancers 14: 1364. - Homann, L., Rentschler, M., Brenner, E., Böhm, K., Röcken, M., and Wieder, Th. (2022)
„IFN-g and TNF induce senescence and a distinct senescence-associated secretory phenotype in melanoma.“
Cells 11:1514. - Dreischer, P., Duszenko, M., Stein, J.,and Wieder, Th. (2022)
„Eryptosis: Programmed Death of Nucleus-Free, Iron-Filled Blood Cells.“
Cells 11: 503 - Krause, B. M., Bauer, B., Neudörfl, J.-M., Wieder, Th., and Schmalz, H.-G. (2021)
„ItaCORMs: Conjugation with a CO-releasing unit greatly enhances the anti-inflammatory activity of itaconates.“
RSC Medicinal Chemistry 12: 2053-2059. - Ghashghaeinia, M., Mrowietz, U. (2021)
„Human erythrocytes, nuclear factor kappa B (NFκB) and hydrogen sulfide (H2S) – from non-genomic to genomic research“
Cell Cycle 2021 Sep 24; 1-11 - Ghashghaeinia, M., Mrowietz, U., Dreischer, P., Köberle, M. (2021)
„Association between nuclear factor of kappa B (NFκB) deficiency and induction of eryptosis in mouse erythrocytes“
Apoptosis, 26: 4-6 - Brenner, E., Schörg, B., Ahmetlić, F., Wieder, Th., Hilke, F.-J., Simon, N., Schroeder, C., Demidov, G., Riedel, T., Fehrenbacher, B., Schaller, M., Forschner, A., Eigentler, T., Niessner, H., Sinnberg, T., Böhm, K., Hömberg, N., Braumüller, H., Dauch, D., Zwirner, S., Zender, L., Sonanini, D., Geishauser, A., Bauer, J., Eichner, M., Jarick, K., Beilhack, A., Biskup, S., Döcker, D., Schadendorf, D., Quintanilla-Martínez, L., Pichler, B., Mocikat, R., Kneilling, M. and Röcken, M. (2020)
“Cancer immune control needs senescence induction by interferon-dependent cell cycle regulator pathways in tumours.”
Nature Communications 11: 1335. - Ghashghaeinia, M., Koralkova, P., Giustarini, D., Mojzikova, R., Fehrenbacher, B., Dreischer, P., Schaller, M., Mrowietz, U., Martínez-Ruiz, A., Wieder, Th., Divoky, V., Rossi, R., Lang, F., and Köberle, M. (2020)
“The specific PKC-a inhibitor chelerythrine blunts costunolide-induced eryptosis.”
Apoptosis 25: 674-685. - Ghashghaeinia, M., Dreischer, P., Wieder, Th., and Köberle, M. (2020)
“Coronavirus disease 2019 (COVID-19), human erythrocytes and the PKC-alpha/-beta inhibitor chelerythrine – Possible therapeutic implication.”
Cell Cycle, 19: 3399–3405. - Ghashghaeinia, M., Köberle, M., Mrowietz, U., Bernhardt, I. (2019)
„Proliferating tumor cells mimick glucose metabolism of mature human erythrocytes“
Cell Cycle, 18: 1316-1334 - Wieder, Th., Eigentler, T., Brenner, E. and Röcken, M. (2018)
„Immune checkpoint blockade therapy.“
J Allergy Clin. Immunol. 142:1403-1414. - Rentschler, M., Chen, Y., Pahl, J., Soria-Martinez, L., Braumüller, H., Brenner, E., Bischof, O., Röcken, M. and Wieder, Th. (2018)
“Nuclear translocation of Argonaute 2 in cytokine-induced senescence.”
Cell Physiol. Biochem. 51: 1103-1118. - Wieder, Th., Brenner, E., Braumüller, H., Bischof, O. and Röcken, M. (2017)
“Cytokine-induced senescence for cancer surveillance.”
Cancer Metastasis Rev. 36: 357-365. - Ghashghaeinia, M., Wesseling, M.C., Ramos, E., Petkova-Kirova, P., Waibel, S., Lang, E., Bissinger, R., Alzoubi, K., Edelmann, B., Hosseinzadeh, Z., Dreischer, P., Shahvaroughi-Farahani, A., Mrowietz, U., Köberle, M., Kaestner, L., Bernhardt, I., Martínez-Ruiz, A., Wieder, Th. and Lang, F. (2017)
“Trifluoperazine-induced suicidal erythrocyte death and S-nitrosylation inhibition, reversed by the nitric oxide donor sodium nitroprusside.”
Cell Physiol. Biochem. 42: 1985-1998. - Bauer, B., Göderz, A.-L., Braumüller, H., Neudörfl, J.M., Röcken, M., Wieder, Th. and Schmalz, H.-G. (2017)
“Methyl fumarate-derived iron carbonyl complexes (FumET-CORMs) as powerful anti-inflammatory agents.”
ChemMedChem 12: 1927-1930. - Wieder, Th., Brenner, E., Braumüller, H. and Röcken, M. (2016)
“Immunotherapy of melanoma: efficacy and mode of action.”
Journal Dtsch. Dermatol. Ges. 14: 28-36. - Ghashghaeinia, M., Giustarini, D., Koralkova, P., Köberle, M., Alzoubi, K., Bissinger, R., Hosseinzadeh, Z., Dreischer, P., Bernhardt, I., Lang, F., Toulany, M., Wieder, Th., Mojzikova, R., Rossi, R. and Mrowietz, U. (2016)
“Pharmacological targeting of glucose-6-phosphate dehydrogenase in human erythrocytes by Bay 11-7082, parthenolide and dimethyl fumarate.”
Scientific Reports 6: 28754. - Braumüller, H., Wieder, Th., Brenner, E., Aßmann, S., Hahn, M., Alkhaled, M., Schilbach, K., Essmann, F., Kneilling, M., Griessinger, C., Ranta, F., Ullrich, S., Mocikat, R., Braungart, K., Mehra, T., Fehrenbacher, B., Berdel, J., Niessner, H., Meier, F., van den Broek, M., Häring, H.-U., Handgretinger, R., Quintanilla-Martinez, L., Fend, F., Pesic, M., Bauer, J., Zender, L., Schaller, M., Schulze-Osthoff, K., and Röcken, M. (2013)
“T-helper-1-cell cytokines drive cancer into senescence.”
Nature 494: 361-365. - Hirschhäuser, C., Velcicky, J., Schlawe, D., Hessler, E., Majdalani, A., Neudörfl, J.-M., Prokop, A., Wieder, Th. and Schmalz, H.-G. (2013)
“Nucleoside Analogues with a 1,3-Diene-Fe(CO)3 Substructure: Stereoselective Synthesis, Configurational Assignment, and Apoptosis-Inducing Activity.”
Chemistry-A European Journal 19: 13017-13029. - Wieder, Th., Braumüller, H., Brenner, E., Zender, L. and Röcken. (2013)
“Changing T-cell enigma. Cancer killing or cancer control?”
Cell Cycle 12: 3146-3153. - Ghashghaeinia, M., Cluitmans, J.C.A., Akel, A., Dreischer, P., Toulany, M., Köberle, M., Skabytska, Y., Saki, M., Biedermann, T., Duszenko, M., Lang, F., Wieder, Th., and Bosman, G.J.C.G.M. (2012)
“The impact of erythrocyte age on eryptosis.”
Journal Haematology 157: 606-614. - Ghashghaeinia, M., Toulany, M., Saki, M., Bobbala, D., Fehrenbacher, B., Rupec, R., Rodemann, H. P., Ghoreschi, K., Röcken, M., Schaller, M., Lang, F. and Wieder, Th. (2011)
“The NFkb pathway inhibitors Bay 11-7082 and parthenolide induce programmed cell death in anucleated erythrocytes.”
Cell Physiol. Biochem. 27: 45-54. - Wieder, Th. and Lang, F. (2010)
Erythrozyten, in: Hämostaseologie, 2. Auflage, B. Pötzsch, K. Madlener, eds.,
Springer-Verlag Berlin Heidelberg New York, pp 113-119. - Lang, E., Lang, P. A., Shumilina E., Qadri, S. M., Kucherenko Y., Kempe D. S., Föller M., Capasso A., Wieder, Th., Gulbins, E., Clemen, C. S., Herr, C., Noegel, A. A., Huber, S. M. and Lang, F. (2010)
“Enhanced eryptosis of erythrocytes from gene-targeted mice lacking annexin A7.”
Arch. Eur. J. Physiol. 460: 667-676. - Ghashghaeinia, M., Bobbala, D., Wieder, Th., Koka, S., Brück, J., Fehrenbacher, B., Röcken, M., Schaller, M., Lang, F. and Ghoreschi, K. (2010)
“Targeting glutathione by dimethylfumarate protects against experimental malaria by enhancing erythrocyte cell membrane scrambling.”
J. Physiol. Cell. Physiol. 299: C791-C804. - Müller-Hermelink, N., Braumüller, H., Pichler, B., Wieder, Th., Mailhammer, R., Schaak, K., Ghoreschi, K., Yazdi, A., Haubner, R., Sander, C. A., Mocikat, R., Schwaiger, M., Förster, I., Huss, R., Weber, W. A., Kneilling, M. and Röcken, M. (2008)
“TNFR1- and IFN-γ-signaling determine whether T cells induce tumor dormancy or promote multistage carcinogenesis.“
Cancer Cell 13: 507-518. - Wieder, Th., Braumüller, H., Kneilling, M., Pichler, B. and Röcken, M. (2008)
“T cell-mediated help against tumors.”
Cell Cycle 7: 2974-2977.
